Science Ch 1,2,3,4 Test Paper UP BOARD सेट – 2
Solution –
Teacher – Subodh Kumar
खंड क
1. रासायनिक समीकरण को संतुलित करने का उद्देश्य क्या है?
- रासायनिक समीकरण को संतुलित करने का उद्देश्य यह होता है कि —
👉 अभिक्रिया में द्रव्यमान संरक्षण के सिद्धांत को बनाए रखा जाए, यानी जितने परमाणु अभिकारकों में हों, उतने ही उत्पादों में भी रहें।
2. अम्ल का स्वाद कैसा होता है?
- अम्ल का स्वाद खट्टा होता है।
3. सबसे हल्की धातु कौन सी है?
- सबसे हल्की धातु लिथियम है।
4. कौन सी धातु पानी में डालने पर तीव्र अभिक्रिया करती है?
- सोडियम धातु पानी में डालने पर तीव्र अभिक्रिया करती है।
5. कार्बन की संयोजकता कितनी होती है?
- कार्बन की संयोजकता 4 होती है।
6. धातु को पीटकर पतली चादर बनाने की क्षमता को क्या कहते हैं?
- धातु को पीटकर पतली चादर बनाने की क्षमता को आघातवर्ध्यता (Malleability) कहते हैं।
7. बेकिंग सोडा का रासायनिक सूत्र लिखो।
- NaHCO₃
8. एल्युमिनियम का प्रतीक क्या है?
- एल्युमिनियम का प्रतीक Al है।
9. हाइड्रोक्लोरिक अम्ल का रासायनिक सूत्र क्या है?
- HCl
10. साबुन बनाने में कौन-सी अभिक्रिया का प्रयोग होता है?
- साबुन बनाने में क्षारीय हाइड्रोलिसिस (Saponification) की अभिक्रिया का प्रयोग होता है।
11. द्रव्यमान संरक्षण का नियम किसने दिया था?
- द्रव्यमान संरक्षण का नियम आंटोनी लावोइज़ियर (Antoine Lavoisier) ने दिया था।
12. मीथेन में कार्बन की संयोजकता कितनी होती है?
- मीथेन (CH₄) में कार्बन की संयोजकता 4 होती है।
खंड ख
1. रासायनिक अभिक्रिया के दो उदाहरण लिखो।
- रासायनिक अभिक्रिया के दो उदाहरण हैं:
- ज्वाला प्रतिक्रिया (Combustion):
CH4+2O2→CO2+2H2OCH₄ + 2O₂ → CO₂ + 2H₂OCH4+2O2→CO2+2H2O - ताम्र धातु का जंग लगना (Rusting of Iron):
4Fe+3O2+6H2O→4Fe(OH)34Fe + 3O₂ + 6H₂O → 4Fe(OH)₃4Fe+3O2+6H2O→4Fe(OH)3
2. अम्ल, क्षार और लवण के गुण व उपयोग लिखो।
- 1. अम्ल (Acid)
गुण:
स्वाद खट्टा होता है।
धातु से प्रतिक्रिया करके हाइड्रोजन गैस छोड़ते हैं।
नीले नीले लीथमस पेपर को लाल कर देते हैं।
उपयोग:
सिरका (Acetic acid) खाना बनाने में।
हाइड्रोक्लोरिक अम्ल (HCl) पाचन में।
नाइट्रिक अम्ल (HNO₃) विस्फोटक और उर्वरक बनाने में।
2. क्षार (Base/Alkali)
गुण:
स्वाद कड़वा या साबुन जैसा।
त्वचा से छूने पर चिपचिपा लगता है।
लाल लीथमस पेपर को नीला कर देते हैं।
उपयोग:
सोडियम हाइड्रॉक्साइड (NaOH) साबुन बनाने में।
अमोनियम हाइड्रॉक्साइड (NH₄OH) सफाई में।
3. लवण (Salt)
गुण:
स्वाद खारा।
जल में घुलनशील होते हैं।
अम्ल और क्षार की प्रतिक्रिया से बनते हैं।
उपयोग:
खाने में स्वाद बढ़ाने के लिए।
रासायनिक प्रयोगों में।
सड़क पर बर्फ पिघलाने के लिए।
3.धातुओं के दो भौतिक गुण लिखो और अधातुओं के दो उदाहरण दो।
- धातुओं के दो भौतिक गुण:
- चमकदार होना – धातु की सतह पर प्रकाश पड़ने पर चमक दिखती है।
- आघातवर्ध्य और चालक – धातु को पीटकर पतली चादर बनाई जा सकती है और यह विद्युत एवं ऊष्मा की अच्छी चालक होती है।
- अधातुओं के दो उदाहरण:
- सल्फर (Sulphur)
- फास्फोरस (Phosphorus)
4. ‘ऑक्सीकरण’ शब्द से तुम क्या समझते हो?
- ऑक्सीकरण वह प्रक्रिया है जिसमें किसी पदार्थ में ऑक्सीजन जुड़ता है या हाइड्रोजन निकलता है।
5. कार्बन के चार संयोजक बंध बनने की विशेषता क्या कहलाती है?
- कार्बन के चार संयोजक बंध बनने की विशेषता को चतुर्थ संयोजकता (Tetravalency) कहते हैं।
6. न्यूट्रलाइजेशन अभिक्रिया क्या है?
- न्यूट्रलाइजेशन अभिक्रिया वह रासायनिक अभिक्रिया है जिसमें अम्ल और क्षार मिलकर लवण और जल का निर्माण करते हैं।
- उदाहरण:
- HCl+NaOH→NaCl+H2OHCl + NaOH → NaCl + H₂OHCl+NaOH→NaCl+H2O
7. ऑक्सीकरण और अपचयन में अंतर लिखो।
- यहाँ ऑक्सीकरण और अपचयन (Reduction) में अंतर दिया गया है:
- क्र.सं.
ऑक्सीकरण (Oxidation)
1. किसी पदार्थ में ऑक्सीजन का जुड़ना या हाइड्रोजन का निकलना.
2. इलेक्ट्रॉनों का हानि होती है - 3. ऊर्जा में वृद्धि
- अपचयन/रिडक्शन (Reduction)
- 1. किसी पदार्थ में ऑक्सीजन का निकलना या हाइड्रोजन का जुड़ना
2. इलेक्ट्रॉनों का लाभ होता है
3.ऊर्जा में कमी
8. सोडियम धातु को मिट्टी के तेल में क्यों रखा जाता है?
- सोडियम धातु को मिट्टी के तेल में इसलिए रखा जाता है ताकि वह हवा और नमी से अभिक्रिया न करे, क्योंकि यह बहुत सक्रिय धातु है और पानी या नमी से तुरंत प्रतिक्रिया कर सकती है।
खंड स
1. रासायनिक अभिक्रिया के प्रकार समझाओ — उदाहरण सहित।
- रासायनिक अभिक्रिया के मुख्य प्रकार निम्नलिखित हैं:
1. सिंथेसिस या संयोजन अभिक्रिया (Synthesis/Combination Reaction)
परिभाषा: दो या अधिक पदार्थ मिलकर एक नया पदार्थ बनाते हैं।
सामान्य रूप: A + B → AB
2. विज्ञप्ति या अपघटन अभिक्रिया (Decomposition Reaction)
परिभाषा: एक यौगिक टूटकर दो या अधिक सरल पदार्थ बनाता है।
सामान्य रूप: AB → A + B
3. स्थानांतरण या विस्थापन अभिक्रिया (Displacement/Replacement Reaction)
परिभाषा: एक तत्व यौगिक में से दूसरे तत्व को विस्थापित करता है।
सामान्य रूप: A + BC → AC + B
4. दोहरे विस्थापन या युग्म प्रतिस्थापन अभिक्रिया (Double Displacement Reaction)
परिभाषा: दो यौगिकों के आयन आपस में बदल जाते हैं।
सामान्य रूप: AB + CD → AD + CB
2. अम्ल और क्षार की विशेषताएँ व उनके दैनिक जीवन में उपयोग लिखो।
- यहाँ अम्ल और क्षार की विशेषताएँ और उनके दैनिक जीवन में उपयोग दिए गए हैं:
1. अम्ल (Acid)
विशेषताएँ:
स्वाद खट्टा होता है।
जल में घुलने पर H⁺ आयन छोड़ते हैं।
नीले लीथमस पेपर को लाल कर देते हैं।
धातुओं से प्रतिक्रिया कर हाइड्रोजन गैस उत्पन्न करते हैं।
दैनिक जीवन में उपयोग:
सिरका (Acetic Acid) – खाना बनाने में।
नींबू का रस (Citric Acid) – स्वाद और पाचन के लिए।
हाइड्रोक्लोरिक अम्ल (HCl) – पेट में पाचन सहायता के लिए।
2. क्षार (Base/Alkali)
विशेषताएँ:
स्वाद कड़वा या साबुन जैसा।
जल में घुलने पर OH⁻ आयन छोड़ते हैं।
लाल लीथमस पेपर को नीला कर देते हैं।
त्वचा से छूने पर चिपचिपा महसूस होता है।
दैनिक जीवन में उपयोग:
सोडियम हाइड्रॉक्साइड (NaOH) – साबुन और डिटर्जेंट बनाने में।
अमोनियम हाइड्रॉक्साइड (NH₄OH) – सफाई और घरेलू उपयोग में।
दूध और बेकिंग पाउडर में हल्के क्षार – खाना पकाने में।
3. धातुओं व अधातुओं के रासायनिक गुणों में 3 अंतर बताओ।
- यहाँ धातुओं और अधातुओं के रासायनिक गुणों में 3 मुख्य अंतर दिए गए हैं
- धातु (Metal)
- अधिकांश धातुएँ ऑक्सीजन के साथ अभिक्रिया कर ऑक्साइड बनाती हैं।
- धातुएँ हाइड्रोजन गैस छोड़ती हैं जब अम्ल के साथ प्रतिक्रिया करती हैं।
- धातुएँ क्षार के साथ न्यूट्रलाइजेशन कर लवण बनाती हैं।
- अधातु (Non-metal)
- अधातुएँ अक्सर ऑक्सीजन के साथ अम्लीय ऑक्साइड बनाती हैं।
- अधातुएँ आमतौर पर अम्ल के साथ हाइड्रोजन गैस नहीं छोड़तीं।
- अधातुएँ आमतौर पर क्षार के साथ अभिक्रिया नहीं करतीं।
4 . कार्बन की संयोजकता और सहसंयोजक बंध की व्याख्या करो।
- यहाँ कार्बन की संयोजकता और सहसंयोजक बंध की व्याख्या दी गई है:
1. कार्बन की संयोजकता (Valency of Carbon)
कार्बन परमाणु में 4 बाहरी इलेक्ट्रॉन्स होते हैं।
यह चार अन्य परमाणुओं से जुड़ सकता है, जिससे नए यौगिक बनते हैं।
इसे चतुर्थ संयोजकता (Tetravalency) कहते हैं।
उदाहरण: मीथेन (CH₄) में कार्बन 4 हाइड्रोजन से जुड़ा है।
2. सहसंयोजक बंध (Covalent Bond)
जब दो परमाणु इलेक्ट्रॉनों को साझा करके बंध बनाते हैं, उसे सहसंयोजक बंध कहते हैं।
यह अम्ल और अधातु के बीच सबसे आम होता है।
उदाहरण: H₂O में ऑक्सीजन और हाइड्रोजन के बीच सहसंयोजक बंध है।
5. अम्ल वर्षा का प्रभाव पर्यावरण पर क्या होता है? समझाओ।
- अम्ल वर्षा का पर्यावरण पर प्रभाव:
पौधों और फसलों पर प्रभाव:
अम्ल वर्षा से मिट्टी में पोषक तत्व कम हो जाते हैं।
पेड़ और पौधों की पत्तियाँ जल कर मर जाती हैं।
फसलों की पैदावार घटती है।
जल स्रोतों पर प्रभाव:
नदियाँ, झीलें और तालाब अम्लीय हो जाते हैं।
उसमें रहने वाले मछलियाँ और जलीय जीव मर सकते हैं।
इमारतों और धातुओं पर प्रभाव:
पत्थर, ईंट, सीमेंट और धातुएँ क्षय और जंग का शिकार हो जाती हैं।
ऐतिहासिक इमारतों और मूर्तियों को नुकसान पहुँचता है।
मनुष्यों पर प्रभाव:
अम्ल वर्षा से पानी और हवा में प्रदूषण बढ़ता है।
सांस लेने में समस्या और त्वचा की परेशानी हो सकती है।
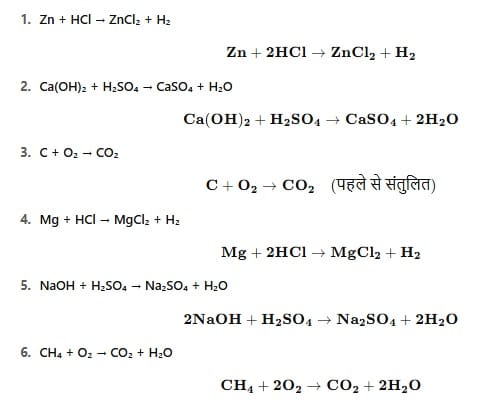
6. निम्न समीकरणों को संतुलित करो:-
Zn + HCl → ZnCl₂ + H₂
Ca(OH)₂ + H₂SO₄ → CaSO₄ + H₂O
C + O₂ → CO₂
Mg + HCl → MgCl₂ + H₂
NaOH + H₂SO₄ → Na₂SO₄ + H₂O
CH₄ + O₂ → CO₂ + H₂O
- यहाँ दिए गए रासायनिक समीकरणों को संतुलित रूप में लिखा गया है: